Аденокарцинома пищевода – форма рака, при которой раковые клетки развиваются из железистых, продуцирующих слизь клеток. Болезнь обычно развивается в нижней трети, в области желудочно-пищеводного перехода.
Рак пищевода является одним из самых агрессивных злокачественных новообразований и занимает восьмое место в структуре смертности в мире. Наиболее частыми морфологическими формами являются плоскоклеточный рак (95%) и аденокарцинома (3%). Крайне редко встречаются, карциносаркома, мелкоклеточный рак и меланома. По расчётам Росстата Минздрава РФ заболеваемость среди мужчин и женщин составляет 7.6 и 2.4 случая на 100 тыс. населения соответственно.
- Факторы риска
- Классификация
- Клиническая картина и симптомы
- Диагностика
- Лечение
- После лечения
- Прогноз
Аденокарцинома считается одной из быстро распространяющихся форм рака пищевода в странах Северной Америки и Европы, в то время как плоскоклеточный рак преобладает в развивающихся странах. Это связано с реализацией факторов риска развития данных форм рака пищевода.
Факторы риска
- Пищевод Барретта – заболевание, при котором нормальный плоскоклеточный эпителий пищевода замещается железистыми клетками. Этот процесс называется кишечная метаплазия и развивается в результате хронического агрессивного воздействия желудочного сока на слизистую пищевода у пациентов с гастроэзофагеальной рефлюксной болезнью и грыжами пищеводного отверстия диафрагмы.
- Ожирение.
- Ахалазия кардии и кардиоспазм.
Классификация
Классификация аденокарциномы пищевода проводится по критериям международной классификации злокачественных новообразований TNM (8-ой пересмотр):
T
- Tis карцинома in situ/дисплазия высокой степени;
- Т1 прорастание опухоли в собственную пластинку или подслизистый слой:
- Т1а собственная пластинка или мышечная пластинка слизистой оболочки;
- Т1b подслизистый слой.
- Т2 прорастание в мышечный слой;
- Т3 прорастание в адвентицию;
- Т4 прорастание прилегающих структур:
- Т4а плевра, брюшина, перикард, диафрагма;
- Т4b – прилежащие органы: аорта, позвонки, трахея.
N
- N0 нет метастазов в регионарных лимфоузлах;
- N1 поражение 1-2 регионарных лимфоузлов;
- N2 поражение 3-6 регионарных лимфоузлов;
- N3 поражение 7 и свыше регионарных лимфоузлов.
М
- М1 наличие отдаленных метастазов.
Регионарными являются следующие группы лимфатических узлов:
- прескаленные,
- внутренние яремные,
- верхние и нижние шейные,
- шейные околопищеводные,
- надключичные (билатеральные),
- претрахеальные (билатеральные),
- лифоузлы корня легкого (билатеральные),
- верхние параэзофагеальные (выше v. azygos),
- бифуркационные,
- нижние параэзофагеальные (ниже v. azygos),
- задние медиастинальные,
- диафрагмальные,
- перигастральные (правые и левые кардиальные, лимфоузлы вдоль малой кривизны желудка, вдоль большой кривизны желудка, супрапилорические, инфрапилорические, лимфоузлы вдоль левой желудочной артерии).
Поражение чревных лимфоузлов не является противопоказанием к проведению химиолучевой терапии и решению вопроса об оперативном лечении.
Степень дифференцировки опухоли
GX – степень дифференцировки опухоли не может быть определена;
G1 – высокодифференцированная опухоль;
G2 – умеренно дифференцированная опухоль;
G3 – низкодифференцированная опухоль;
G4 – недифференцированная опухоль.
В классификации аденокарциномы пищевода выделяют кардиоэзофагеальный рак, т.е. рак, развивающийся в области пищеводно-желудочного перехода и кардии.
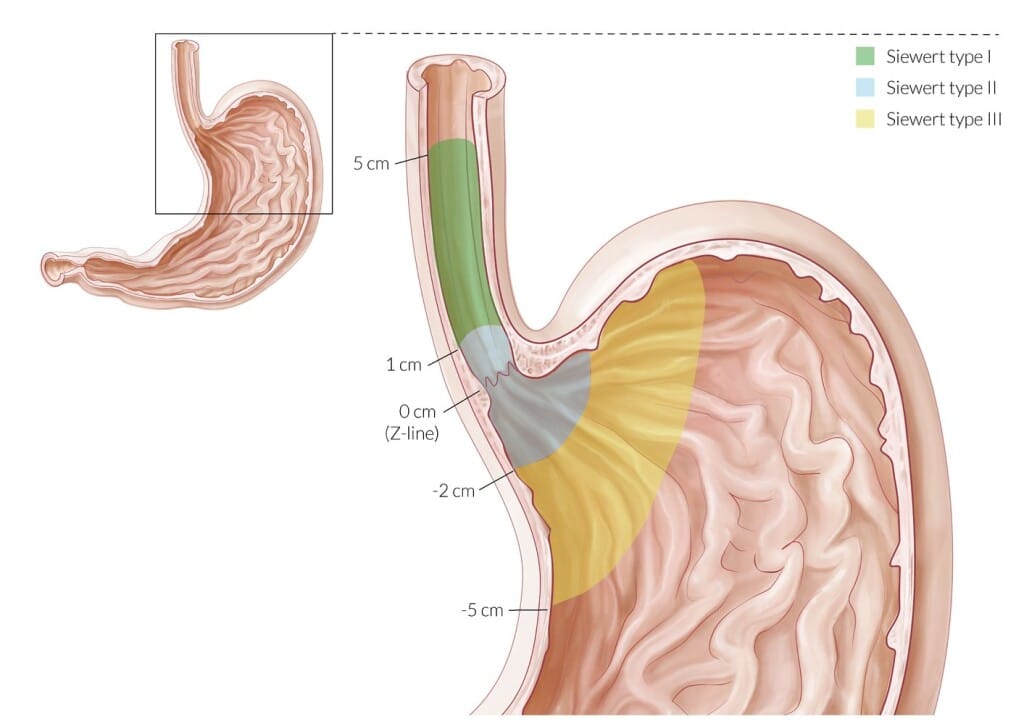
Классификация Зиверта
Аденокарцинома пищеводно-желудочного перехода, согласно классификации Зиверта, подразделяется на 3 типа:
I тип – аденокарцинома дистального отдела пищевода (часто ассоциируется с пищеводом Баррета), центр опухоли расположен в пределах 1–5 см выше кардии (зубчатой линии);
II тип – истинная аденокарцинома зоны пищеводно-желудочного пере хода (истинный рак кардии), центр опухоли расположен в пределах 1 см выше и 2 см ниже кардии (зубчатой линии);
III тип – рак с локализацией основного массива опухоли в субкардиальном отделе желудка в пределах 2–5 см ниже зубчатой линии и возможным вовлечением дистальных отделов пищевода.
Опухоли пищеводно-желудочного перехода I и II типа подлежат лечению согласно алгоритмам, соответствующим РП. Опухоли III типа подлежат лечению согласно алгоритмам, соответствующим раку желудка.
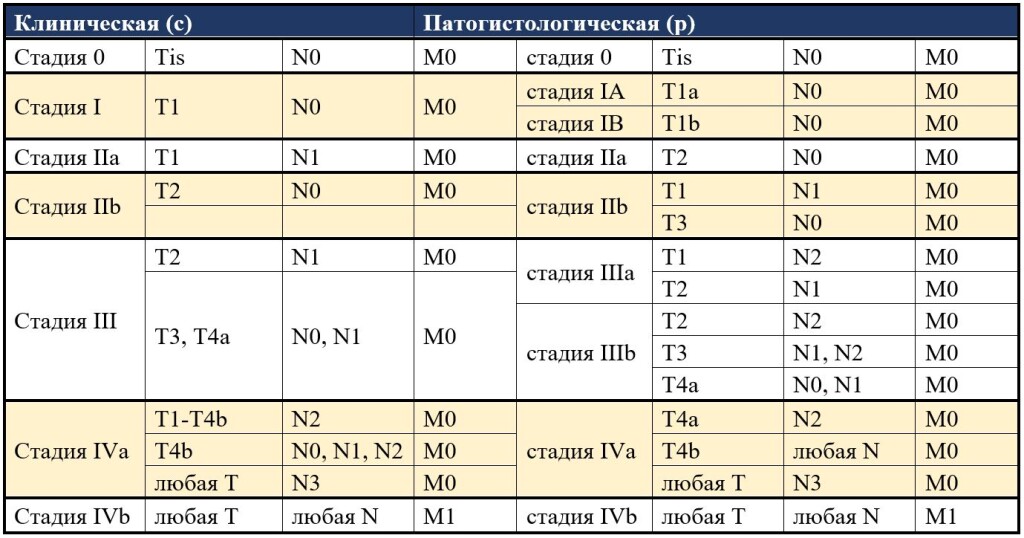
Классификация аденокарциномы пищевода по стадиям
Клиническая картина и симптомы
Ранние стадии аденокарциномы пищевода при отсутствии сужения просвета пищевода часто протекают бессимптомно и являются случайной находкой при проведении эндоскопического исследования в связи с другими заболеваниями пищевода или обследовании. Отдельно следует обратить внимание на проведение планового динамического эндоскопического исследования у пациентов с гастроэзофагеальной рефлюксной болезнью и пищеводом Барретта, входящими в группу риска по развитию аденокарциномы пищевода.
При развитии опухоли, суживающей просвет пищевода (обычно, при сужении менее 15 мм), основным клиническим проявлением является синдром дисфагии, который включает в себя:
- Затруднение при проглатывании пищи, застревание пищи в пищеводе (дисфагия);
- Немотивированное снижение массы тела на фоне уменьшения питания;
- Срыгивание (регургитация) съеденной пищей;
- Чувство давления и дискомфорта в грудной клетке;
- Боли при проглатывании пищи (редко);
- Слюнотечение (редко).
К признакам распространенного заболевания относятся:
- Прогрессирующая дисфагия (от затруднения при проглатывании твердой пищи до невозможности проглотить жидкости и слюну);
- Значительное снижение массы тела вплоть до развития кахексии (крайнего истощения);
- Лихорадка;
- Боли в костях;
- Одышка;
- Загрудинная боль или боль в спине;
- Признаки кровотечения из желудочно-кишечного тракта (рвота с кровью, черный стул (мелена), анемия в общем анализе крови).
Диагностика заболевания
Оптимальный план обследования для постановки диагноза, определения клинической стадии и выработки лечебного плана должен включать в себя следующие процедуры:
- Основным методом диагностики является эзофагогастродуоденоскопия. Она позволяет получить материал для морфологического подтверждения диагноза, а также оценить распространенность первичной опухоли по пищеводу. С целью повышения информативности метода в настоящее время могут применяться такие методики, как хромоэндоскопия, эндоскопия в узко-спектральном пучке света, аутофлюоресценция.
- Эндосонография (Эндо-УЗИ) является наиболее информативным методом в оценке глубины инвазии опухоли в стенку пищевода (символ Т). Также она позволяет с высокой точностью (чувствительность 0,8 и специфичность 0,7) оценить состояние регионарных лимфоколлекторов. Для более точного предоперационного стадирования и определения тактики лечения возможно выполнение пункционной биопсии медиастинальных лимфатических узлов.
- Рентгеноконтрастное исследование пищевода.
Рентгенография пищевода с барием у больного раком пищевода
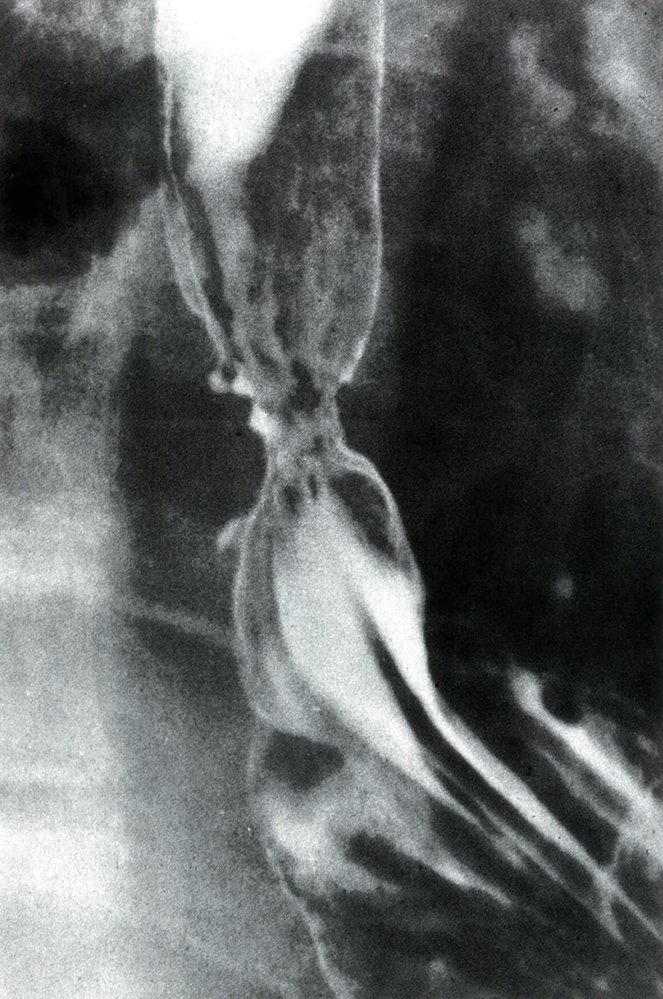
- КТ органов грудной клетки и брюшной полости с внутривенным контрастированием. Выполняется для оценки состояния регионарных лимфоузлов и исключения отдаленных метастазов. По сравнению с эндо-УЗИ она обладает меньшей чувствительностью (0,5), но большей специфичностью (0,83) в диагностике регионарных метастазов. Для отдаленных метастазов этот показатель составляет 0,52 и 0,91 соответственно.
- Совмещенная позитронно-эмиссионная компьютерная томография с 18F дезоксиглюкозой (ПЭТ/КТ) малоинформативна для определения T и N-статуса. Но она демонстрирует более высокую чувствительность и специфичность в обнаружении отдаленных метастазов по сравнению с КТ. ПЭТ/КТ рекомендуется выполнять в случае, если у пациента по данным КТ нет отдаленных метастазов (М1).
- Фибробронхоскопия выполняется для исключения инвазии в трахею и главные бронхи при опухолях пищевода, расположенных на уровне или выше ее бифуркации.
При подготовке к хирургическому лечению с целью оценки функционального статуса по показаниям проводят дополнительные функциональные тесты: эхокардиографию, холтеровское мониторирование, исследование функции внешнего дыхания, УЗДГ сосудов, исследование свёртывающей системы крови, анализы мочи, консультации врачей-специалистов (кардиолога, эндокринолога, невропатолога и т.п.).
Хирургическое лечение
Показаниями к проведению хирургического лечения являются локализованные (ранние) формы рака пищевода без поражения окружающих структур: I-IIA (Т1-3N0M0). Также операция показана с высокой степенью дисплазии при пищеводе Барретта, которая рассматривается как cr in situ.
Хирургическое лечение включает проведение:
- Эндоскопической мукозэктомии (удаление слизистой пищевода) при расположении злокачественных клеток в пределах слизистой. Эндоскопическая резекция является методом выбора при carcinoma in situ и при тяжелой дисплазии. Кроме того, метод успешно применяется при опухолях пищевода, не выходящих за пределы слизистой, у больных, имеющих значительный риск хирургических осложнений. При этом 5-летняя выживаемость достигает 85-100%.
- Субтотальную резекцию пищевода с одномоментной пластикой желудочной трубкой или сегментом толстой кишки.
Основным видом операции является трансторакальная субтотальная резекция пищевода с одномоментной внутриплевральной пластикой стеблем желудка или сегментом толстой кишки с билатеральной двухзональной медиастинальной лимфодиссекцией из комбинированного лапаротомного и правостороннего торакотомного доступов (типа Льюиса).
В некоторых клиниках в качестве альтернативы выполняются трансхиатальные резекции пищевода, которые не могут претендовать на радикальность. Они не должны применяться у пациентов раком грудного отдела пищевода, поскольку из лапаротомного доступа невозможна адекватная медиастинальная лимфодиссекция выше бифуркации трахеи.
Другим путем уменьшения числа хирургических осложнений является минимально инвазивная (торако-лапароскопическая) или гибридная (торакотомия+лапаросокопия или торакоскопия + лапаротомия) эзофагэктомия или робот-ассистированная резекция пищевода.
Подробнее про операцию читайте по ссылке. Предупреждаем, что материалы содержат изображения натуралистического характера.
Комбинированное лечение. Химио- и лучевая терапия
Результаты одного хирургического лечения более распространенных стадий остаются неудовлетворительными, 5 лет переживают лишь около 20% больных. В целях улучшения результатов используются различные сочетания лекарственной и лучевой терапий (предоперационная химиотерапия, предоперационная химиолучевая терапия, самостоятельная химиолучевая терапия).
Химиотерапия
А. Предоперационная (неоадъювантная) химиотерапия;
Б. Послеоперационная (адъювантная) химиотерапия.
При аденокарциноме нижнегрудного отдела пищевода или пищеводно-желудочного перехода наиболее оправдано проведение периоперационной химиотерапии, когда 2-3 курса химиотерапии назначаются до операции, а 3-4 курса – после нее. При выявлении гиперэкспрессии HER 2neu в режимы терапии включается трастузумаб в стандартных дозах.
При аденокарциноме нижнегрудного отдела пищевода или пищеводно-желудочного перехода послеоперационная химиотерапия показана, если она проводилась и предоперационно. Адъювантная химиотерапия в самостоятельном виде при аденокарциноме пищевода в настоящее время не рекомендуется.
Лучевая терапия
Проведение одной лучевой терапии (без химиотерапии) до или после хирургического лечения не показано по причине малой эффективности.
А. Предоперационная химиолучевая терапия
Перед химиолучевой терапией возможно проведение 1-2 курсов химиотерапии, что позволяет у большинства больных уменьшить дисфагию и заранее запланировать лучевую терапию.
Крайне желательно проведение дистанционной лучевой терапии на линейных ускорителях. Разовая очаговая доза составляет 1,8-2 Гр, суммарная – до 44-45 Гр. Во время лучевой терапии проводится химиотерапия на основе цисплатина или карбоплатина. При наличии выраженной дисфагии перед началом облучения производят эндоскопическую электрореканализацию/ аргонно-плазменную реканализацию пищевода или пункционную гастростомию.
Хирургическое вмешательство обычно производится через 6-8 недель после завершения химиолучевой терапии.
Оптимальным режимом химиолучевой терапии представляется еженедельное введение паклитаксела и карбоплатина на фоне 5 недель лучевой терапии. Такой предоперационный режим (по сравнению с только хирургией) позволяет достигнуть полного патоморфоза у 23% больных аденокарциномой. Послеоперационная летальность составляет 4%, а 5-летняя выживаемость улучшена с 34% до 47%.
Б. Послеоперационная химиолучевая терапия
Послеоперационная химиолучевая терапия может быть проведена пациентам в удовлетворительном состоянии при наличии микро или макроскопической резидуальной опухоли (после R1 или R2-резекции). Режимы и дозы аналогичные предоперационным.
Самостоятельная химиолучевая терапия
Альтернативой хирургическому лечению операбельных местно-распространенных форм рака пищевода является химиолучевая терапия, которая позволяет достичь сравнимой 5-летней общей выживаемости 20-27%. В прямом сравнительном исследовании самостоятельной химиолучевой терапии на основе цисплатина и инфузии 5-фторурацила и одной операции не было достигнуто достоверных различий в отдаленных результатах, а токсичность и летальность консервативного лечения были значительно ниже.
Крайне желательно проведение конформной 3D CRT дистанционной лучевой терапии на линейных ускорителях энергией 6-18 Мев, а также на протонных комплексах работающих с энергией70-250 Мев. Разовая очаговая доза составляет 1,8-2 Гр, суммарная – до 50-55 Гр. Увеличение СОД не приводит к улучшению результатов, повышая лишь летальность.
Во время лучевой терапии проводится химиотерапия, чаще на основе цисплатина и инфузий 5-фторурацила. При наличии выраженной дисфагии, перед началом облучения производят эндоскопическую электрореканализацию пищевода или пункционную микрогастростомию. Химиолучевая терапия нередко осложняется развитием лучевых эзофагитов и усилением степени выраженности дисфагии, что усугубляет нутритивный дефицит пациента и ухудшает переносимость лечения. В таких ситуациях возможен частичный или полный переход на парентеральное питание, постановка временной пункционной микрогастростомы.
Выбор между самостоятельной химиолучевой терапией или хирургическим лечением (с или без предоперационной химиолучевой терапией) зависит от локализации первичной опухоли, функционального состояния больного и опыта хирурга. Так, у сохранных пациентов с локализацией опухоли в средней или нижней трети пищевода предпочтительнее включение в план лечения операции.
При сохранении жизнеспособной опухоли после химиолучевого лечения или местном рецидиве возможно выполнение так называемой «спасительной эзофагэктомии».
Паллиативное лечение неоперабельных больных
Основными задачами лечения пациентов с метастатическим раком пищевода являются устранение болезненных симптомов, увеличение продолжительности жизни.
Оценка эффективности различных режимов химиотерапии рака пищевода затруднена отсутствием рандомизированных исследований. По этой причине даже сложно оценить и тот выигрыш, который дает химиотерапия по сравнению с поддерживающей терапией.
Проведение химиотерапии рекомендуется пациентам в удовлетворительном состоянии и отсутствием выраженной (III-IV) дисфагии, затрудняющей адекватное питание пациента. В последнем случае на первом этапе показано восстановление проходимости пищевода (стентирование, реканализация). При дисфагии I-II степени начало химиотерапии позволяет добиться уменьшения степени ее выраженности у ряда больных уже к концу первого курса.
Наиболее активными препаратами при обоих гистологических вариантах являются цисплатин, фторпиримидины, таксаны. Кроме того, при аденокарциномах также эффективны оксалиплатин, иринотекан, трастузумаб (при гиперэкспрессии HER-2 neu).
После лечения
Осмотр
Пациенты после радикального лечения (хирургия или химиолучевая терапия) должны осматриваться каждые 3-6 мес. в первые 2 года, далее каждые 6-12 мес. в последующие 3-5 лет, затем ежегодно.
Анализы
Анализы крови и инструментальные обследования назначаются только по клиническим показаниям (появление жалоб или симптомов прогрессирования).
ЭГДС
Пациенты с ранним раком, которые подверглись эндоскопической резекции слизистой, должны выполнять ЭГДС каждые 3 мес. в первый год, каждые 6 мес. на второй и третий годы, далее – ежегодно.
Прогноз
Прогноз при аденокарциноме пищевода определяется стадией заболевания. К сожалению, особенности строения пищевода, высокий риск метастазирования, отсутствие специфической клинической картина на ранних стадиях заболевания, приводят к тому, что 2/3 пациентов к моменту установки диагноза имеют 3 или 4 стадию. Это либо местно-распространенный неоперабельный процесс либо отдаленные метастазы в легких, печени, костях. В данном случае 12-месячная выживаемость составляет лишь 38%.
При локализованных стадиях 5-летняя выживаемость может достигать 47%, при поражении регионарных лимфоузлов – 25%, при наличии отдаленных местастазов не превышает 5%.
Хирургическое лечение в отделении торакоабдоминальной хирургии и онкологии РНЦХ
Лечение в отделении проводится по программам ОМС, ДМС, ВМП, а также на коммерческой основе.
Читайте, как попасть на лечение в отделение торакоабдоминальной хирургии и онкологии РНЦХ.
Для записи на консультацию позвоните по телефонам:
+7 (903) 728 24 52
+7 (499) 248 15 55
Отправьте заявку на консультацию, заполнив форму на нашем сайте и прикрепив необходимые документы.
